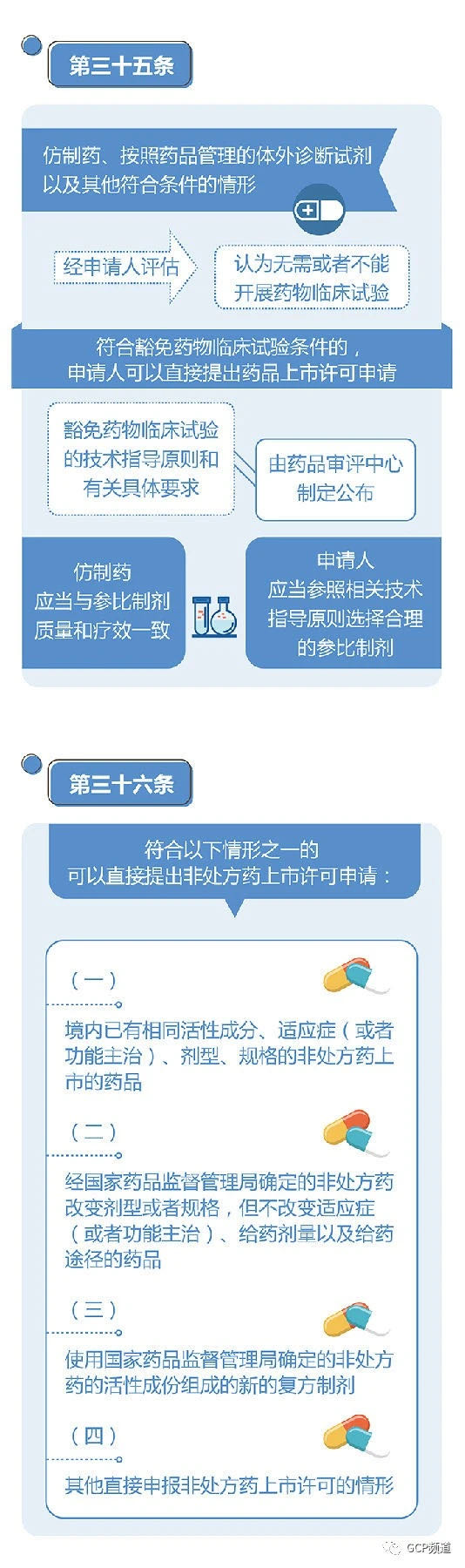
药品注册需要的条件包括以下几个方面。
1、药品质量可控性:申请人必须确保其药品具备安全性和有效性,并且药品生产过程稳定可靠,质量可控,这意味着需要提供充分的证据来证明药品的质量和纯度,包括生产工艺验证、质量控制和测试方法等,申请人还需要提交关于药品质量标准、生产工艺和质量控制等方面的详细资料。

2、药品安全性和有效性:药品必须经过充分的临床试验证明其安全性和有效性,申请人需要提供关于药品的药理作用、毒理学研究、药效学试验和临床试验等方面的详细资料和数据,这些数据需要通过科学的方法收集和分析,以确保药品的安全性和有效性得到验证,申请人还需要提交关于药品不良反应监测计划,以确保药品上市后能够及时发现和处理不良反应问题。
3、药品合规性:申请人需要确保其药品符合国家的法律法规要求,包括药品注册相关的法规、标准和技术要求等,申请人还需要遵守相关的知识产权保护规定和商业道德准则等,在申请过程中,需要提供相关的证明文件和许可证等文件资料。
4、其他条件:除了以上主要条件外,还有一些其他条件需要考虑,如申请人需要具备相应的研发和生产能力、药品的分类和命名需要符合相关规定等,还需要注意不同国家和地区可能有不同的注册要求和程序,申请人需要了解并遵守当地的法律法规要求。
药品注册是一个复杂的过程,需要申请人具备全面的专业知识和经验,以确保其药品符合国家的法律法规要求和质量标准,以上内容仅供参考,如需更多信息,建议咨询专业机构或查阅相关法规。