药品注册管理办法是规范药品注册行为,加强药品注册监督管理的重要法规。以下是关于2020年药品注册管理办法的解读。
1、目的和适用范围:该办法旨在规范药品的注册行为,保证药品的安全、有效和质量可控,适用于中华人民共和国境内药品的注册及相关管理工作。
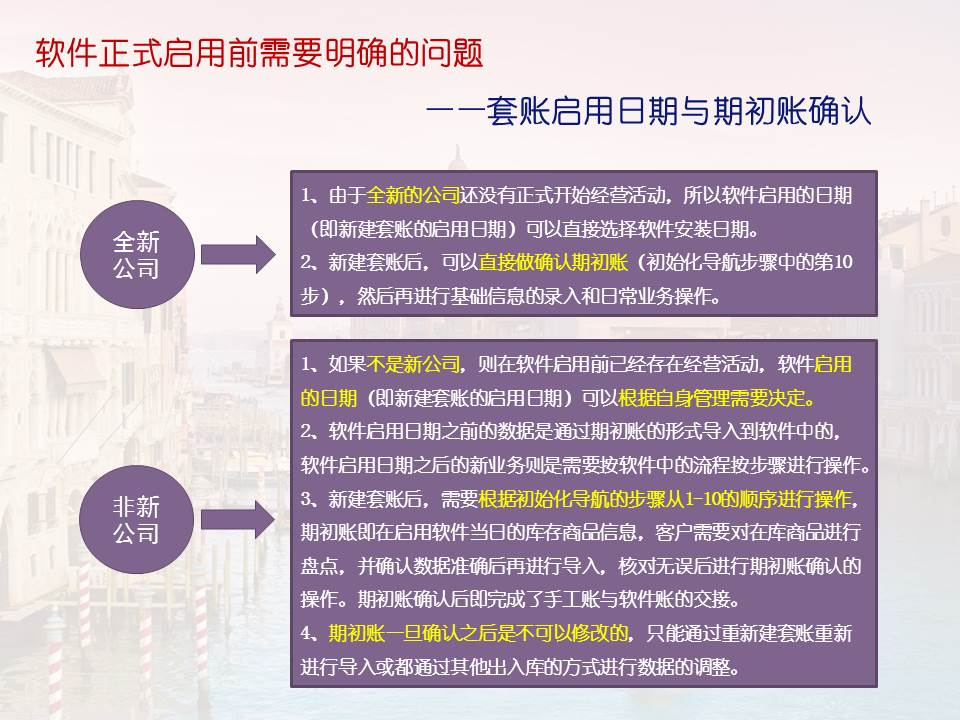
2、药品注册原则:实行全过程监管原则,包括原料、辅料、包装材料、生产工艺、质量控制等各个环节,实行品种审批原则,对每种药品进行独立的评价和审批。

3、申请人要求:明确申请人为药品研制的主要承担者,需要具备相应的研发能力、生产条件和质量控制能力,申请人的资质和条件在办法中有详细规定。
4、审评审批流程:明确药品审评审批的流程,包括申请、受理、审评、审批、公告等环节,建立审评审批的内部控制机制,确保审评审批的公正、透明和高效。
5、药品的安全性和有效性:强调药品的安全性和有效性是药品注册的核心要求,申请人需要提供充分的药学、药理毒理学和临床试验等数据来证明药品的安全性和有效性。
6、监督管理:药品监督管理部门负责对药品注册申请进行审查,并对批准的药品进行监督管理,包括生产、流通、使用等各个环节的监管,确保药品的质量和安全。

7、鼓励创新药的研发:在办法中体现了对创新药的鼓励和支持,为创新药的研发提供便利和优惠政策。
8、与其他法律法规的关系:该办法与其他药品相关的法律法规相互衔接,共同构成药品监管的法律体系。
2020年的《药品注册管理办法》更加明确和规范了药品注册的流程和要求,加强了药品注册的监督管理,旨在保证药品的安全、有效和质量可控,以上解读仅供参考,如需更专业的解读,建议查阅官方文件或咨询相关领域的专家。