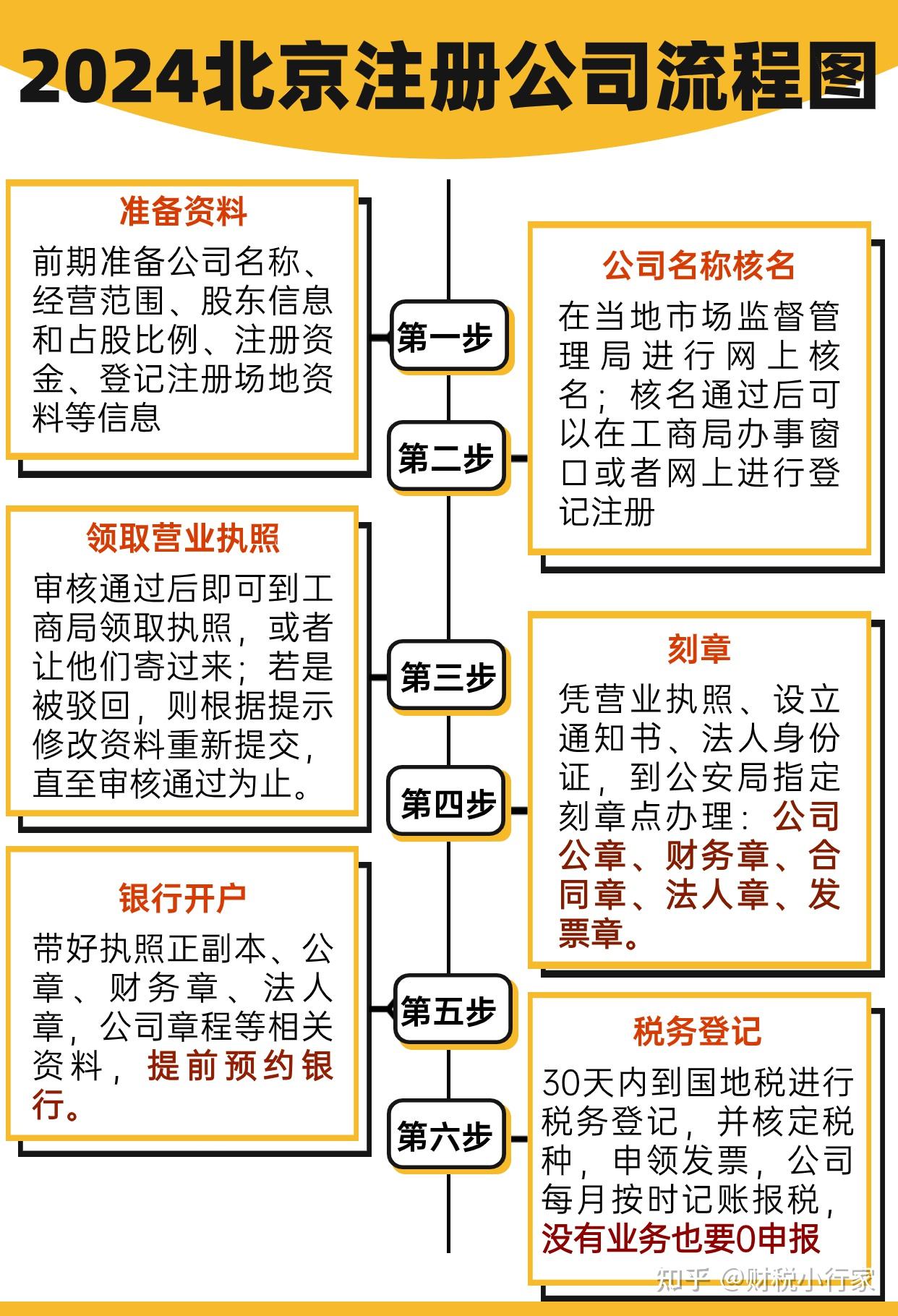
药品注册管理办法细则是由国家药品监督管理局制定并实施的,用于规范药品的注册管理,确保药品的安全、有效和质量可控。以下是该细则的一些关键内容。
1、药品注册的基本要求:包括申请人资格、申请资料要求、申请程序等,申请人需要具备一定的资质和条件,提交的资料应当真实、准确、完整。
2、药品注册的分类管理:包括新药注册、仿制药注册、进口药品注册等,不同类型的药品注册,其审批流程和要求也有所不同。

3、药品注册的审批流程:包括受理、初审、现场核查、技术评审、审批决定等环节,审批过程中,需要对申请资料进行全面、严谨的技术审查,确保药品的安全性和有效性。
4、药品注册后的监管:包括药品生产企业的日常监管、药品质量的抽检、不良反应监测等,药品注册后,监管部门将继续对药品的安全性、有效性、质量可控性进行监管。
5、法律责任:申请人、药品生产企业等应当遵守药品注册管理的相关规定,如违反相关规定,将承担相应的法律责任。

除了上述内容,细则还可能包括一些具体的操作指南、审批标准、审批时限等,以确保药品注册管理工作的规范化和标准化。
具体的药品注册管理办法细则可能会因为政策的更新而有所调整,建议通过访问国家药品监督管理局官方网站或其他权威渠道来获取最新的信息。