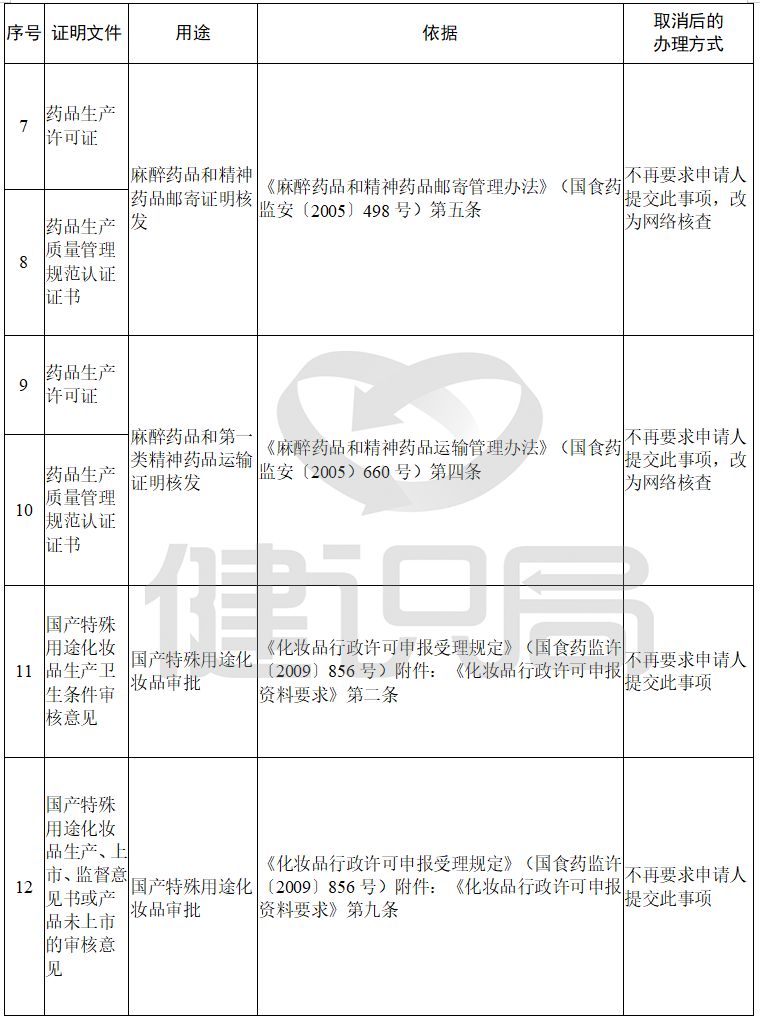
药品企业注册管理办法实施细则全文如下。
第一章 总则
第一条 为规范药品企业注册管理,根据《药品管理法》、《药品注册管理办法》等有关规定,制定本细则。
第二条 在中华人民共和国境内申请药品企业注册,适用本细则。
第二章 申请与受理
第三条 药品企业注册申请应提交的材料包括:
(一)申请表;
(二)证明性文件;

(三)企业名称、地址等信息。
第四条 药品监管部门应在收到申请材料后,对申请进行审查,符合要求的,予以受理;不符合要求的,不予受理并说明理由。
第三章 技术审查与现场核查
第五条 药品企业应按照有关规定进行技术审查,包括生产工艺、质量控制、安全性等方面的审查。
第六条 药品监管部门应对申请企业进行现场核查,核实企业实际情况与申请材料的一致性。
第四章 审批与决定
第七条 药品企业注册申请经技术审查、现场核查后,药品监管部门应作出审批决定,符合条件的,颁发药品企业注册证书;不符合条件的,不予注册并说明理由。
第八条 药品企业注册证书有效期为五年,到期后需重新注册。
第五章 监督管理

第九条 药品企业应遵守药品注册管理的相关规定,保证药品的安全、有效、质量可控。
第十条 药品监管部门应对药品企业进行监督检查,对违反规定的,依法给予处罚。
第六章 附则
第十一条 本细则自发布之日起施行,由XX部门负责解释。
第十二条 本细则修订时,由XX部门负责起草,提交相关部门审议后公布实施。
是关于药品企业注册管理办法实施细则的全文,不同地区可能有更具体的地方性法规或操作指南,应以当地法规为准,如有任何疑问,建议向当地药品监管部门咨询。
仅供参考,具体条款可能会因实际情况而有所调整。